BENZENA DAN TURUNANNYA
Pengertian benzena
Benzena adalah senyawa organik siklik
(berbentuk cincin) dengan enam atom karbon yang bergabung membentuk cincin segi
enam Rumus molekulnya adalah C6H6.
Rumus struktur merupakan ikatan rangkap terkonjugasi:
Turunan benzena
Atom H dari inti benzena digantikan oleh atom atau gugus molekul lain.
Contoh untuk monosubstitusi:
Pembuatan BENZEN:
1) Sulingan bertingkat terbatu bara. Selain
benzena terdapat zat-zat lain seperti fenol, toluena, ksilena, naftalena, dan
antrasena. Masing masing dapat dipisahkan berdasar perbedaan titik didih.
2)
Pemanasan kering Ca-benzoat dan
Ca-hidroksida:
1) Reaksi substitusi, berlangsung
dengan katalis. Substitusi halogen dengan katalis Fe, FeCl3, atau AlCl3
4) Substitusi dengan
sulfon: benzena dan H2SO4 Pekat
Sifat-sifat benzena
1) Cairan tak
berwarna, mudah terbakar.
2) Uap benzena
bersifat racun, berbau tak enak.
3) Tak larut dalam
air tetapi larut dalam alkohol dan eter.
4) Membeku pada suhu
5,5 °C dan mendidih pada suhu 80,1 °C.
5) Reaksi adisinya
tidak semudah pada alkena.
Kegunaan
1) Bahan untuk
obat-obatan.
2) Pelarut lemak, damar, lilin.

a. Pembuatan
Nitrasi
(penitroan) benzena sebagai berikut
b. Reaksi khusus
1)
Reduksi nitrobenzena menghasilkan anilina
2) Dengan amoniak
memberikan anilina (suasana alkohol)
Sifat-sifat
1) Cairan berwarna
kuning.
2) Bersifat racun.
3) Bersifat
higroskopis.
4) Tak dapat
dihidrolisis.
5) Karena bersifat
basa, maka dengan asam menghasilkan garam anilina.
Kegunaan
1) Untuk membuat
bahan wewangian.
2) Untuk bahan
pengoksidasi.
3) Bahan baku pembuatan anilina.

a. Pembuatan
1) Reduksi nitrobenzena
2) Fenil klorida dan
amonia dipanaskan sampai 200 °C dengan katalis Cu2O di bawah tekanan
b. Reaksi khusus
1)
Dengan asam membentuk garam
2) Dengan asam nitrit membentuk fenol
Sifat-sifat
1) Cairan tak
berwarna.
2) Sukar larut dalam
air.
3) Bersifat basa
lemah.
Kegunaan
1) Untuk bahan
pewarna.
2) Untuk analisis organik
FENOL
a. Pembuatan
1) Sulingan bertingkat
batu bara.
2) Pemanasan K-benzena sulfonat dengan KOH
3) Anilina
dengan asam nitrit (lihat reaksi khusus anilina).
b. Reaksi khusus
1) Bereaksi dengan logam alkali
2)
Dapat direduksikan oleh seng menghasilkan benzena
3) Dengan campuran
HNO3
pekat
+ H2SO4 pekat menghasilkan
asam pikrat
Sifat-sifat
1) Padatan tak
berwarna yang higroskopis.
2) Larut dalam
pelarut organik.
3) Bersifat asam
lemah.
Kegunaan
1) Bahan desinfektan.
2) Bahan pembuat zat
pewarna.
3) Bahan pembuat
plastik.
4) Karbol adalah larutan fenol.
TOLUEN

a. Pembuatan
1)
Sintesis Friedel dan Craft:
2)
Sintesis Wurtz dan Fittig:
b. Reaksi khusus
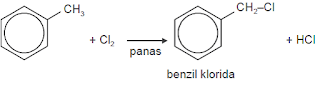
1) Jika dipanaskan
dengan halogen, terbentuk benzil Halida
2)
Dengan halogen dan katalis, terbentuk halotoluena
3) Dengan HNO3 pekat
+ H2SO4 pekat
dapat terbentuk trinitro toluena
4)
Jika dioksidasi terbentuk asam benzoat
ASAM BENZOAT
1) Oksidasi
toluena:
b. Reaksi khusus
1)
Dengan logam alkali terbentuk garam
2)
Bereaksi dengan PX3/PX5 membentuk
benzoil halida.
Sifat-sifat
1) Sifat keasamannya
lebih kuat daripada asam asetat.
2) Benzoil klorida
dengan amonia terbentuk benzamida.
Kegunaan
1) Untuk bahan
pengawet.
2) Untuk bahan obat-obatan.
STIRENA
Pembuatan:
Benzena dengan etena
ditambah katalis AlCl3 dipanaskan sampai 900 °C.
Kegunaan:
untuk bahan dasar karet sintetik dan plastik.

















































Tidak ada komentar:
Posting Komentar